Cuba: Primeros resultados de eficacia de Soberana 02 y Abdala deben conocerse en este mes de junio
“En este mes de junio debemos conocer los primeros resultados de eficacia de ambas vacunas que se encuentran en el ensayo clínico fase III”, destacó Eduardo Martínez Díaz, presidente de BioCubaFarma.
CAPAC- Por Lissett Izquierdo Ferrer/ Tomado de Cubadebate/ Foto: AP.
“Quisiéramos que nuestra vacuna tuviese un 100% de eficacia, pero eso sabemos que no sería real. Los estudios que estamos realizando en estos momentos, los realizamos en un escenario donde ya están circulando en nuestro país otras variantes del virus, como la cepa detectada por primera vez en Sudáfrica y que es una de las declaradas como de ׳preocupaciónʹ, por la Organización Mundial de la Salud (OMS), y ante la cual se ha visto que otras vacunas que tienen ya permiso de uso de emergencia disminuyen su eficacia, según estudios realizados. No escapa esa variante del virus de la protección de esa vacuna, pero sí disminuye la eficacia. Ello quiere decir que las evaluaciones clínicas nuestras las estamos realizando en un contexto verdaderamente retador para nuestros candidatos vacunales”, dijo Martínez Díaz, al abordar los estudios sobre la eficacia de los candidatos vacunales cubanos.
Explicó que en los estudios clínicos fase II de Soberana 02 y Abdala, se ha evidenciado que los niveles de anticuerpos protectores que neutralizan al virus, están alrededor del 95 %, es decir que inducen altos títulos de anticuerpos.
Incluso, un por ciento de las personas de alrededor de 1000 voluntarios que participaron en esta fase hiperresponden a la vacuna con muy altos títulos de anticuerpos.
“Pensamos que la eficacia de los candidatos vacunales cubanos supere el 50%, pero debemos esperar los resultados de los ensayos fase III. Decir cualquier número ahora sería especular. Ahora tenemos que ver si ese alto número de personas levanta anticuerpos protectores, como en las fases anteriores; y si existen anticuerpos protectores por encima de un 20%, lo que está demostrado es que después hay una correlación con la eficacia”, dijo Martínez Díaz.
Los estudios—remarcó— se están realizando con muchísimo rigor, la N de nuestros ensayos es grande, porque la incidencia no es tan alta. Incluso el pasado año, en medio del desarrollo de los candidatos vacunales, la incidencia era menor y en un momento pensamos que tendríamos que ir a otros lugares a realizar los estudios de eficacia. “Desgraciadamente se incrementó la incidencia, pero el contexto nos permite con esta N que se calculó, llegar a tener los resultados de eficacia”, señaló.
El doctor Vicente Vérez Bencomo, director general del Instituto Finlay de Vacunas (IFV), señaló que existe una tendencia al “menosprecio de las vacunas que han reportado un 50% de eficacia”.
“Ese 50% no está puesto a dedo, sino que es un indicador que está puesto sobre la base de cuando se impacta en la mitad de las personas que se vacunan, se logra reducir en cierta medida la circulación y se logra incidir sobre la transmisión de la enfermedad. Por lo tanto, es preciso eliminar el menosprecio respecto a una vacuna de 50% contra una de 90% de eficacia, porque lo necesario es utilizarla vacuna que esté disponible. Si tiene una vacuna de 50% utilícela, porque ello se verá reflejado en detener la enfermedad”, opinó.
En esta carrera por las vacunas, añadió, ha existido menosprecio por los países menos desarrollados y por las vacunas también. “Hablamos de que algunas de las vacunas que tienen 90% frente a la cepa original, en los ensayos clínicos que se han hecho contra la cepa detectada en Sudáfrica tienen un 60 %”, señaló.
Vérez Bencomo refirió que los científicos cubanos son soñadores. “Estamos convencidos de que hemos puesto lo mejor de nuestra ciencia detrás de nuestras vacunas, y obtendremos buenos indicadores de eficacia, en el escenario donde se están moviendo nuestros candidatos”, dijo.
Insistió que la batalla contra la COVID-19 no termina con las vacunas, sino con todo el esfuerzo mancomunado de lograr, primero, que las vacunas lleguen a toda la población mundial, porque mientras el virus siga circulando, continúa mutando y se convierte en una amenaza para todos y para las vacunas también.
Eduardo Martínez Díaz, presidente de BioCubaFarma, mencionó el estudio de intervención en población de riesgo, iniciado en paralelo con el ensayo clínico fase III, en los trabajadores de la Salud y BioCubafarma; el cual también arrojará datos de la efectividad de las vacunas.
“Hemos estado evaluando permanentemente qué ha estado ocurriendo, ya se han inmunizado un alto por ciento de los trabajadores de BioCubaFarma y estamos viendo resultados respecto a la cantidad de personas con PCR positivos y enfermos de COVID-19”, apuntó.
Eulogio Pimentel, vicepresidente de BioCubaFarma, señaló que la intervención en BioCubaFarma no concibe el uso de placebo, sino de las dosis indicadas. “En nuestra organización, al menos con una dosis ya se han inmunizado 16 711 trabajadores. Después de esta inmunización, en este momento de esta cifra, resultaron ser PCR positivo a COVID-19 (aunque la eficacia de una vacuna se mide contra el enfermo, no contra el positivo porque se puede tener el virus y no desarrollar la enfermedad) 144 personas. Después de la segunda dosis, que han recibido 14 758 trabajadores, se detectan 47 positivos a PCR; y luego de la tercera dosis que ya abarca alrededor del 50% de los trabajadores, esta cifra de contagios baja a 21”, dijo.
“Hablamos de la suma de trabajadores inmunizados con Abdala y con Soberana 02, y los datos muestran una tendencia a la disminución de los casos positivos entre los trabajadores de BioCubaFarma, usando ambos candidatos vacunales, en un contexto donde se ha incrementado la incidencia”, señaló Pimentel.
Comentó que están en curso otros estudios que utilizan modelos matemáticos, para de acuerdo con los datos que se están obteniendo en municipios de La Habana que están siendo objeto de la intervención, qué predicción están dando los modelos y qué está pasando con los datos reales de disminución, luego de una primera dosis en estos territorios.
Se trabaja en recopilar toda la información para solicitar el autorizo de uso de emergencia
“Desde hace varios días la agencia regulatoria nos convocó y se comenzó un proceso para ir evaluando todo lo hecho en los últimos tiempos —ellos han examinado todo el proceso, pues para poder hacer un Fase III tuvieron que evaluar los resultados de las Fases I y II—. Ahora estamos evaluando todos los elementos que tienen que ver con el proceso productivo; nuevas informaciones que hemos brindado de los estudios preclínicos y de los estudios de estabilidad de la vacuna en el tiempo. El conjunto de esas informaciones se está preparando para presentarlas a la autoridad regulatoria, de modo que cuando tengamos la primera información de eficacia, ya se hayan evaluado los otros elementos y podamos acceder en un menor tiempo a un permiso de uso de emergencia”, apuntó Eduardo Martínez Díaz, presidente de BioCubaFarma.
“La agencia regulatoria cubana, el Cecmed, nos ha estado acompañando, como han hecho las agencias regulatorias en el mundo en general, en todos estos procesos. Ellos tienen interacción directa con la OMS y participan en un grupo de foros donde se comparten los aspectos regulatorios que guían el desarrollo de las vacunas en el contexto en que lo estamos haciendo”, agregó.
La doctora Marta Ayala Ávila, directora general del Centro de Ingeniería Genética y Biotecnología (CIGB), reiteró que el candidato vacunal Abdala se encuentra en Fase III de ensayos clínicos. Ya concluyó la fase de inmunización el 1ro de mayo y a partir del 3 de mayo, se empezaron a contar los individuos que iba a estar acumulando 14 días o más de la última inmunización, dijo.
Recordó que el esquema de Abdala es de tres dosis, espaciado en 0, 14 y 28 días.
“Durante todo el estudio fase III, a partir de que se protocoliza y se organiza, los individuos están siendo vacunados, ya sea en el grupo placebo o en el de candidato vacunal, y se monitorizan aquellos que van siendo PCR positivo, para también ir evaluando cuál es la evolución de su sintomatología o su evolución hacia la gravedad o hacia el desenlace fatal, que es el fallecimiento”, precisó.
En este caso, señaló, el estudio clínico Abdala se desarrolla en la región oriental: en los municipios cabecera de Santiago de Cuba y Guantánamo y en el municipio Bayamo, en Granma. El hospital que acoge a los individuos positivos a la COVID-19 y los evalúa está en el municipio de Santiago de Cuba. Hacia allí se ha movido ya el grupo de especialistas clínicos monitores nuestros, porque ahora estamos en la fase de evaluación de la variable de eficacia.
“Nosotros estamos caminando hacia el primer corte interino, que una vez que nos pueda dar resultados esperados, podremos estar en condiciones de presentar una solicitud de autorizo de uso de emergencia al Cecmed. Por supuesto, el estudio de fase III continúa. El diseño estadístico y el diseño por protocolo incorpora una N cantidad de individuos a ser analizados, y cómo ha sido para otras vacunas que han sido aprobadas para su uso por un autorizo de uso condicionado: han hecho cortes interinos que permitirán tomar decisiones, como por ejemplo para una solicitud de autorizo de su uso. Por eso es tan importante que trabajemos con la agencia reguladora cubana en vistas de tener toda la documentación lista, para solicitar este autorizo de uso, que estamos aspirando que sea en el mes de junio, pero que va a depender de cómo evolucione la recogida y la presencia de los casos PCR positivos y cómo sea la evaluación de la sintomatología”, detalló la científica.
Apuntó que al tratarse de un estudio clínico controlado, aleatorizado, con grupo de control con placebo, pues habrá un momento también en que se deba decodificar para poder evaluar lo que está ocurriendo en ese primer corte interino.
En cuanto al corte interino en la Fase III de Soberana 02+ Soberana Plus, el doctor Vicente Vérez Bencomo, director general del Instituto Finlay de Vacunas (IFV), explicó que ya concluyó la aplicación de la dosis de Soberana Plus al grupo de sujetos que tenía este esquema de vacunación (hay tres brazos en esta investigación: el esquema de dos dosis, el de tres dosis y el de placebo).
Este es un ensayo complejo, que está diseñado para medir eficacia de una sola dosis en primer lugar; después medir eficacia de dos dosis de Soberana 02, y, finalmente, medir eficacia de dos dosis de Soberana 02 más una de Soberana Plus, dijo.
Vérez Bencomo señaló que es un estudio que va a tener varios cortes. El primer corte interino siempre está hecho sobre la base de la estadística óptima, o sea, el número mínimo de personas que, saliendo positivas y cayendo en el grupo de placebo, permite hacer una evaluación estadística de un 100% de eficacia. Por lo que ese primer corte interino es un punto de análisis. Estamos avanzando, no estamos lejos de alcanzar el número de positivos que se requieren para realizar este primer corte interino como resultado de eficacia de dos dosis, comentó el experto.
Ahora, dijo, está en proceso la limpieza de las bases de datos, pues son varias bases de datos que se conectan: la primera es de vacunados, la segunda de positivos, la tercera es de hospitalizados, y después hay que seguir la evolución de estos datos.
Pensamos que en las próximas dos semanas pueda haber un primer corte interno para eficacia de dos dosis, sostuvo.
“Eficacia de dos dosis quiere decir que si esa eficacia sobrepasara el 50%– hay que tener en cuenta que en La Habana en estos momentos está circulando fundamentalmente la cepa sudafricana, por lo que estaríamos midiendo eficacia en tiempo real contra esa cepa en específico– que es el criterio estándar, o llegamos a él, estaríamos hablando de una posibilidad de solicitud de uso de emergencia del esquema de dos dosis de Soberana 02”, comentó.
Obviamente, todos los resultados inmunológicos dicen que dos dosis de Soberana 02 más una de Soberana Plus es mucho mejor que dos dosis de Soberana 02, por lo tanto, este estudio va a seguir para, en un momento determinado, tener un autorizo de emergencia de esta denominación, que en términos inmunológicos ha demostrado estar muy bien a partir de los resultados de la Fase II, agregó el director general del Instituto Finlay de Vacunas (IFV).
Científicos cubanos: Sí estamos publicando los resultados, pero está siendo un proceso difícil
“Las publicaciones de todos los resultados de las vacunas y del resto de los medicamentos los estamos haciendo. Ya hay varias publicaciones que están en estos momentos en revistas, que son públicas, y otras que se están preparando y están siendo enviadas. O sea, todos los resultados se van a publicar”, afirmó el presidente de BioCubaFarma.
Sin embargo, este no está siendo un camino libre de obstáculos, ratificaron varios científicos cubanos. De acuerdo con la doctora Ayala Ávila, “en medio de la pandemia hemos tenido la necesidad casi que de publicar en tiempo real, o sea realizar la experimentación, la salida de resultados y publicar rápidamente”.
“Quiero decirles que no ha sido sin dificultades, porque el bloqueo se materializa también en las áreas de investigación, a partir de la limitación de recursos muchas ocasiones, porque en nuestras capacidades intelectuales está bien claro cuáles son los mejores experimentos y las mejores técnicas que podemos utilizar. En muchos laboratorios del mundo donde hemos estado, a esos reactivos y esas técnicas se accede en 24 horas; acá no lo podemos hacerlo en 24 horas, y no es porque no sepamos dónde buscarlos, sino porque hay limitaciones financieras y también porque si viene de los Estados Unidos no lo podremos adquirir”, comentó la directora del CIGB, institución que desarrolla el candidato vacunal Abdala.
En términos de publicación—agregó—, nosotros sí estamos listos para publicar los resultados. “Tenemos un ejemplo de hace solo 48 horas. Todo el desarrollo preclínico del candidato vacunal Abdala se puso a disposición de la revista Vaccine para su revisión el viernes 28 de mayo. Se nos asignó un código y un minuto después nos rechazaron sin que pasara a revisión en la aplicación de la publicación. Dijeron: porque tienen muchas aplicaciones, tienen que hacer un balance… Y ¿cómo pudiéramos interpretar esto, es bloqueo, es discriminación? Porque, además, tenemos tradición de publicar en la revista Vaccine, tenemos científicos que revisan publicaciones de esta revista, y créanme, la publicación que enviamos tiene mucha calidad. Sin embargo, ha sido rechazada para su revisión”, comentó Ayala Ávila.
Sobre el tema también ejemplificó el doctor Vicente Vérez Bencomo. “La primera publicación que salió relacionada con las Soberanas fue enviada por primera vez a una revista en el mes de octubre de 2020, y apareció publicada en esa revista hace tres o cuatro días”, dijo.
“ Estamos hablando de que los grados de interacción con una revista, con los revewers, si además la publicación viene de Cuba…son complejos; en una entrevista publicada recientemente hablábamos de eso, del menosprecio, la marginación de las publicaciones por el lugar de dónde provienen como un elemento frecuente y que influye en que los tiempos sean largos; que los revewers pongan cuestionamientos que a lo mejor no se los pondrían a otras publicaciones que vienen de otros lugares”, explicó.
Con esto queremos decir que sí estamos publicando—afirmó Vérez Bencomo—, no estamos escondiendo los resultados. “Tenemos una segunda publicación que es toda la preclínica de Soberana 02, la cual en estos momentos está cerca de ser aceptada por ACS Chemical Biology una revista de la sociedad americana de Química; tenemos una publicación de la Fase I de ensayo clínico que está en Lancet Infectious Diseases, después de haber sido posteada”, explicó.
“Aquí hay un elemento importante de la ciencia moderna que deber ser tenido en cuenta: hay servidores que promueven que usted ponga en ellos la publicación antes de enviarla a la revista, pero lo que se pone en esos servidores no se reconoce como prioridad a la hora de publicar, y por ejemplo, este artículo que enviamos ahora a Lancet….fue lo primero que se presentó de un ensayo clínico de una vacuna hecho con convalecientes en el mundo. Sin embargo, después de eso han aparecido más cosas, y ninguna nos ha citado con prioridad, cuando lo primero que se hizo de ensayos clínicos en convalecientes con vacunas anticovid-19 la hicimos nosotros. O sea, que ese es el riesgo de entregar las cosas, de postear las ideas de lo que uno tiene. Eso lo hicimos hace meses”, ejemplificó el director general del IFV.
Al respecto agregó: “Nosotros no estamos reusando nada, nuestro trabajo tiene un basamento científico muy fuerte y estamos en el camino de hacerlo, y lo vamos a hacer por todas las vías posibles. Estamos convencidos de la ciencia que estamos haciendo. Nosotros, en el caso de Soberana, tenemos cinco publicaciones en fase de preparación: está la publicación de la fase I 2A, de la combinación de dos más Plus; está la 2B; está la publicación de la Fase II del ensayo con convalecientes, que incluyó a 450 convalecientes y dio resultados muy buenos; están las de los resultados de Soberana 1. O sea, hay un grupo de publicaciones en preparación en las que tenemos la duda ahora mismo si postearlas o no, pues de no hacerlo corremos el riesgo de que, como ha pasado, no se reconozca luego nuestro trabajo”, dijo.
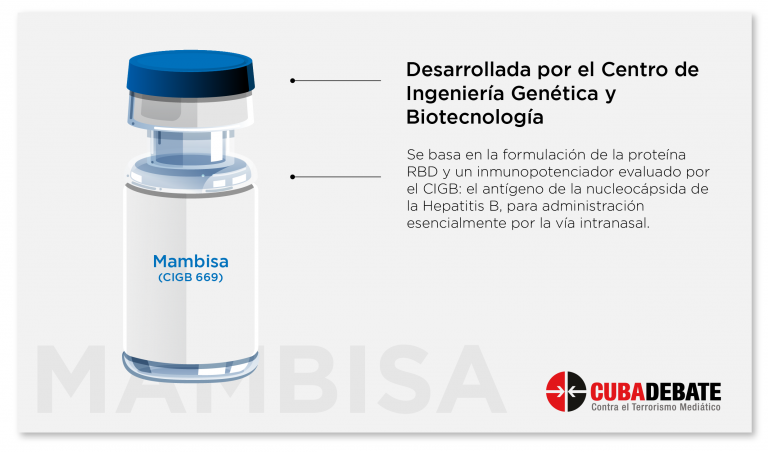
¿Qué pasa con Mambisa y Soberana 01?
Respecto al candidato vacunal Mambisa, que continúa siendo el inmunógeno en desarrollo propuesto para utilizar la vía de administración intranasal, la doctora Marta Ayala señaló que luego de haber realizado los estudios fase I para evaluar su seguridad e inmunogenicidad, con dos esquemas de dosis
Mambisa es un candidato vacunal que tiene dos componentes: se basa en la formulación de la proteína RBD y un inmunopotenciador evaluado por el CIGB: el antígeno de la nucleocápsida de la Hepatitis B, este último que ha sido por más de 15 años desarrollado en nuestros laboratorios, y está presente por ejemplo en la vacuna recombinante contra la Hepatitis B (HeberNasvac) y tiene potente actividad inmunomoduladora, es capaz de estimular la inmunidad innata y en presencia de otro antígeno también es capaz de producir la inmunidad mucosal y la inmunidad sistémica , explicó la experta.
Este candidato vacunal combina ambos componentes y su formulación está preparada para ser administrada por la vía intranasal, que utiliza el SARS-CoV-2 para penetrar y a través de la cual se transmite. “Lo que hemos estado evaluando es colocar este candidato vacunal en un nicho donde las personas necesiten dosis de refuerzo, que son convalecientes y vacunados, que varios meses después tengan disponible esta vía noble de administración. Pueden existir individuos que necesiten tener otras vías de administración”, comentó.
Ello, dijo, nos permite evaluar el papel de la activación de la inmunidad de la mucosa en eliminar la transmisión e incluso el impacto sobre la sintomatología de individuos que puedan estar en condiciones de ser reinfectados aún cuando estén convalecientes o vacunados.
Al respecto, señaló que con el ensayo clínico fase I/II con convalecientes también se está estudiando con el CECMED y el Centro Nacional Coordinador de Ensayos Clínicos, evaluar tres dispositivos para la administración de la vía intranasal: uno que se utilizó en el fase I pero que por cuestiones del bloqueo no será posible seguir adquiriendo, y otros dos: uno para gotas nasales y otro con un sistema de espray que se ha estado fabricando en la industria con la impresión 3D y la colaboración del Centro de Neurociencias de Cuba.
“Se trata de elegir entre los dos que nos será más factible tener, con cuál continuaremos. Mambisa puede ser un candidato vacunal muy atractivo, no solo en el escenario cubano donde ya hay un número considerable de convalecientes y donde también se está evaluando a Soberana Plus, sino en el mundo, porque hay millones de convalecientes.
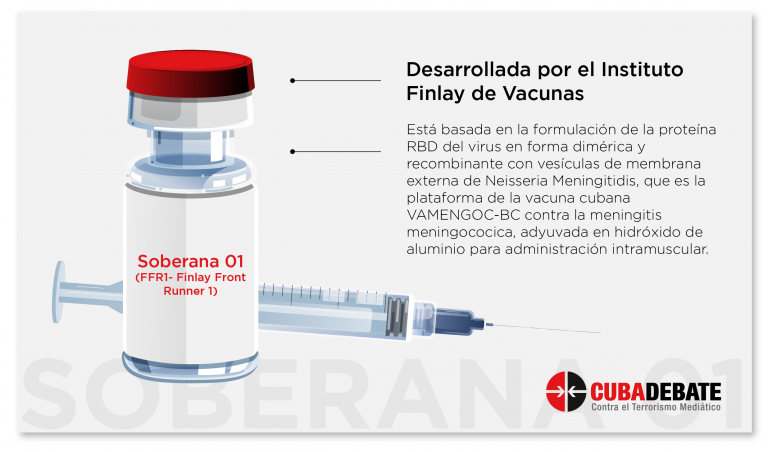
Sobre el concepto de desarrollo de las Soberanas, el doctor Vicente Vérez Bencomo, director general del Instituto Finlay de Vacunas (IFV), puntualizó que Soberana se mueve hacia la inmunidad T, que emite todas las señales de alarma necesarias para que el organismo responda, Soberana 01 se mueve a utilizar las proteías de membrana externa del meningococo para estimular la inmunidad innata como primera barrera o señal de alarma.
“Lo que hemos visto con Soberana 01 es que es muy buena estimulando a todo el mundo (en el sistema inmune) y ello pensamos es un dato importante en términos de resultados. Estamos en la fase final de la preparación del protocolo para el ensayo fase II/III y aspiramos poder comenzarlo a finales del mes de junio”, dijo.
Comentó que se planifica un escalado hacia arriba (población 60-80) y uno hacia abajo (población pediátrica) en la medida que se avanza en el ensayo.
Cuba tiene experiencia de trabajo con OMS para certificar vacunas
Cuba fabrica ocho de las vacunas utilizadas en el esquema de inmunización del país, comentó Eduardo Martínez, presidente de BioCubaFarma. “Tanto la vacuna contra la Hepatitis B como la vacuna contra el Haemophilus influenzae tipo B han sido certificadas por la Organización Mundial de la Salud (OMS). Tenemos experiencia y trabajo previo con la OMS para certificar sistemas productivos y en general las vacunas que fabricamos”, dijo.
Comentó que la organización se ha mantenido en intercambio con la representación de OPS/OMS en Cuba y se le ha puesto al tanto de la marcha del desarrollo de los candidatos vacunales en el país, así como que se ha mantenido comunicación con la OMS. “En este proceso, que es paulatino, la prioridades a corto plazo ahora son concluir los estudios, recopilar los resultados disponibles, y estamos concentrados en fabricar las vacunas. Paralelo al desarrollo de las vacunas hemos estado desarrollando sistemas productivos, implementando los escalados productivos, tanto del antígeno como del producto final”, señaló.
Rolando Pérez Rodríguez, director de ciencia e investigación de Biocubafarma, señaló que la certificación de la OMS “en parte nos ayuda a compatibilizar las exigencias regulatorias cubanas con las internacionales, es una manera de validar, de certificar lo que estamos haciendo, y va a facilitar el acceso de los candidatos vacunales, en un futuro vacunas, a otros países de la región y en general del mundo”.
“Nosotros estamos abiertos a ese proceso, como se ha dicho, y ya hemos transitado en esa dirección. Debo decir también que la agencia regulatoria cubana tiene una interacción amplia con la OMS y la OPS y con otras agencias regulatorias en el mundo, relaciones bilaterales, y todo este proceso sería con el acompañamiento del Cecmed, que es la agencia reguladora cubana. Es un proceso positivo que va a darle consistencia y validez a todo lo que estamos haciendo”, consideró Pérez Rodríguez.
La aspiración sigue siendo vacunar al 70% de la población para el mes de agosto
No obstante los obstáculos del cerco financiero y económico que enfrenta el país, la doctora Marta Ayala ratificó que “tenemos un cronograma de producción, con escalas superiores, estamos acumulando las vacunas, estamos buscando proveedores nuevos que nos puedan suministrar los insumos y, por supuesto, una vez que tengamos el permiso de uso de emergencia de esas vacunas, vamos a poder contar con las dosis para cumplir con el compromiso de que el 70% de la población cubana pueda estar vacunada en el mes de agosto”.
Por su parte, el presidente de BioCubaFarma afirmó que se trata de con candidatos vacunales sustentados en diferentes plataformas tecnológicas y el escalado de estas plataformas requiere insumos y determinados recursos diferentes.
“Hemos enfrentado afectaciones con un grupo de insumos necesarios tanto para la fabricación de las vacunas como de otros fármacos. Nos ha sido más fácil, porque teníamos en existencia los recursos para lograr un escalado mayor, en el caso de Abdala que en el caso de Soberana 02. Ha sido una cuestión logística, de recursos disponibles, accesibilidad a proveedores…, y la decisión ha sido que todas las vacunas disponibles se utilicen; o sea, que en estos momentos tenemos las condiciones para ir incrementando las producciones y la disponibilidad de la Soberana y paulatinamente se irá incorporando mayores intervenciones con estos productos, de manera que se equiparen en un futuro”.
En esta diversidad de plataformas dijo, radica una de las ventajas de tener varios candidatos con diferentes tecnologías, pues contituye una fortaleza ante escenarios adversos como este, sostuvo.
Intercambios con más de 30 países sobre candidatos vacunales cubanos
“Hay un déficit de vacunas en el mundo muy grande. Cada día estamos recibiendo solicitudes desde muchos países del mundo, y en estos momentos estamos desarrollando intensos intercambios con más de 30 naciones, que están relacionados tantos con gobiernos como con empresas privadas”, afirmó en conferencia de prensa Mayda Mauri Pérez, Vicepresidenta de BioCubaFarma.
Señaló que tan pronto los candidatos vacunales cubanos cuenten con los autorizos de uso de emergencia que debe otorgar la autoridad reguladora nacional, Cuba estará en condiciones de empezar a pasar los procesos regulatorios de los diferentes países, de “ir materializando los acuerdos con un principio fundamental: no firmaremos contratos que no podamos cumplir y en eso seremos rigurosos y objetivos”, subrayó.
Como una experiencia positiva reciente, Mauri Pérez mencionó la visita entre el 26 y 29 de mayo de la Ministra de Salud de Argentina, Dra. Carla Vizzoti, y la Asesora presidencial Cecilia Nicolini, quienes junto al el embajador de la nación sudamericana en Cuba, Luis Alberto Larregui, sostuvieron un fructífero encuentro con autoridades del sector biofarmacéutico y de salud en el país y conocieron del favorable impacto de los 27 productos cubanos en el tratamiento contra la COVID-19 y del avance de los ensayos clínicos de los candidatos vacunales Soberana02 y Abdala.
“La visita respondió a un mandato de los presidentes de ambos países de evaluar la cooperación entre Cuba y Argentina en el combate a la pandemia”, señaló.
“Sostuvimos conversaciones sobre el interés de Argentina de poder contar con las vacunas cubanas en su estrategia de vacunación. Argentina ha estado adquiriendo vacunas de muchos países, pero también ha decidido evaluar con objetividad la posibilidad de que las cubanas contribuyan a la inmunización de la población argentina, y en esto avanzamos. Evaluamos además de qué forma podíamos unirnos para lograr que estas vacunas estuviesen disponibles no solo para Cuba y Argentina sino para el resto de la región y de otros países del mundo que las puedan necesitar”, dijo.